Hallo,
dieser Thread sollte ursprünglich eine Frage werden, habe jedoch gemerkt, dass ich daraus vielmehr eine allgemeine Einführung formuliert habe. Es geht darum anhand der drei Kriterien und insbesondere der Hückel-Regel zu bestimmen ab wann eine monocyclische Verbindung zu den
Aromaten zählt. Zu entscheiden ob ein Stoff ein Aromat ist oder nicht ist nicht so einfach wie bei den üblichen Stoffgruppen der OC. Zunächst einmal muss die Verbindung cyclisch sein, das zu erkennen dürfte kein Problem darstellen. Die Planarität kann man sich manchmal noch herleiten, in den meisten Fällen ist das aber wohl eher Lernsache. Und was die vollständige Konjugation angeht, das erkennt man leicht; wenn beispielsweise zwei Einfachbindungen (sp³-hybridisiert, ohne weitere Besonderheiten) "nebeneinander" im Ring sind ist es schon nicht mehr ganz durchkonjugiert und somit kein Aromat mehr. Aufpassen muss man allerdings zum Beispiel bei Kationen und Anionen, denn dadurch kann ein System durchaus wieder "konjugiert" sein. Daher wäre es gut folgende Definition ergänzend im Hinterkopf zu behalten: "Alle Atome des Rings müssen sp²-hybridisiert sein." (Quelle:
Wikipedia - Aromaten)
Mit der Regel sp^{n-1} kann man sich ganz schnell ausrechnen welche Hybridisierung ein Atom hat. Man nimmt einfach die Anzahl der "Partner" eines Atoms (wobei auch freie Elektronenpaare zählen!) und zieht hiervon eins ab, so erhält man relativ schnell die Hybridisierung eines Atoms. Beispiel: Das C-Atom im dritten Molekül, welches die positive Ladung trägt; es hat drei "Partner" - den Wasserstoff, der dort nicht eingezeichnet ist und zwei weitere C-Atome. Das macht (3 - 1) sp²-Hybridisierung. Keine Gewähr, dass diese "Regel" immer funktioniert. Sie dient nur als Orientierungshilfe.
Schlussendlich nur noch die Hückel-Regel. Man zählt einfach die Elektronenpaare ab, wobei zwei π-Elektronen einem Elektronenpaar entsprechen und schaut sich hiernach die Formel (4n + 2) π-Elektronen an. Was genau bedeutet das? π-Elektronen sind die Elektronen, die oberhalb oder unterhalb der Kernverbindungsachse sind, d.h. es sind in den allermeisten Fällen die Doppelbindungselektronen. Als kleines Beispiel: Beim Benzol haben wir drei Elektronenpaare, mithin sechs π-Elektronen. Also die Bestimmung der π-Elektronen ist ganz einfach, man muss sie nur ablesen - hiernach versucht man durch probieren auf n zu kommen. Z.B. wenn es sechs π-Elektronen gibt lautet die Formel: 6 = 4n + 2, nach n aufgelöst ergibt das n = 1. Prinzipiell darf man für n alle positiven ganzen Zahlen und null einsetzen, "kein Aromat" ist es nur, wenn für n keine ganzen Zahlen bei heraus kommen. Der Definitionsbereich von n ist bei Aromaten und Antiaromaten prizipiell n = 0, 1, 2, 3 ... Wie z.B. n = 1/2 (s. unteres Beispiel). Das ist die Formel um zu überprüfen ob es sich um einen Aromaten handelt, leider ist die Definition eines Aromaten nicht ganz so eindeutig wie die der anderen Stoffklassen; Alkohole erkennt man meist an der OH-Gruppe, Carbonsäuren an der COOH-Gruppe, usw., aber für Aromaten muss man zunächst einmal die Kriterien durchgehen und ggf. kurz rechnen. Es gibt jedoch noch eine weitere Gruppe, die sogenannten "Antiaromaten", was nicht zu verwechseln ist mit "kein Aromat", denn ein "Antiaromat" stellt so ziemlich das Gegenteil des Aromaten dar und "kein Aromat" ist einfach nur die Aussage, dass es sich um keinen Aromaten handelt.
Diese Begriffe werden leider nicht immer gut getrennt - daher bitte drauf achten. Die Hückel-Formel für Antiaromaten ist [4n] π-Elektronen, das bedeutet, wenn bei n = (Anzahl der π-Elektronen)/4 eine ganze positive Zahl bei herauskommt liegt ein Antiaromat vor (s. letztes Beispiel). Ist analog zur gewöhnlichen Hückel-Regel. Um das Wissen zu vertiefen folgt eine Übungsaufgabe aus dem
Buddrus.
Aufgabe: Welche der folgenden Verbindungen sind olefinisch, aromatisch bzw. antiaromatisch?
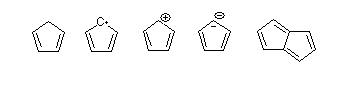
Damit eine organische Verbindung zur Substanzklasse "Aromaten" zählt muss sie folgende Bedingungen erfüllen:
- planar
- cyclisch
- konjugiertes π-System
- ungerade Anzahl an π-Elektronenpaaren gemäß der Hückel-Regel
Lösungsansatz:
Ich bezeichne nunmehr die oben dargestellten Moleküle mit "A", "B", usw. (A = Cyclopentadien, B = Cyclopentadienyl-Radikal, C = Cyclopentadienyl-Kation, D = Cyclopentadienyl-Anion, E = Pentalen). Bei Molekül A wird sofort ersichtlich, dass es kein Aromat ist. Gemäß der Hückel-Regel (4n + 2) π-Elektronen erhält man, da zwei Elektronenpaare = vier Elektronen vorhanden sind, n = 1/2. Da n keine positive, ganze Zahl ist reicht allein dieses Kriterium schon aus um es als Aromat auszuschließen, wobei es sowieso auch nicht durchkonjugiert ist (also auch kein Antiaromat) - Molekül A ist ein sogenanntes "Olefin" (= ältere Bezeichnung für
Alken).
Anders sieht die Sache bei Molekül B aus; hier haben wir ein konjugiertes System. Da an "oberster" Stelle des Moleküls nun ein einzelnes Elektron vorhanden ist (= Radikal), ist dieser Kohlenstoff folglich sp²-hybridisiert und daraus folgt ja, dass es "konjugiert" ist (beim ersten Molekül ist eine sp³-Hybridisierung vorhanden, wodurch es kein vollständig konjugiertes System ist). Die Forderung "cyclisch" ist auch kein Problem, das ist bei allen Molekülen in dieser Aufgabe gegeben. Die Planarität bereitet bei vielen auf Anfängerniveau am meisten Schwierigkeiten, aber wir nehmen mal an, dass diese zwei Moleküle auch planar gebaut sind (ich empfehle hier die Planarität der gängigsten Strukturen mehr oder weniger "auswendig zu lernen"). Nun entscheidet die Hückel-Regel um welche Art von Stoffklasse es sich handelt, es besitzt jetzt allerdings fünf π-Elektronen, somit ist n keine ganze Zahl. Nach der [4n]π-Elektronen-Regel kommt ebenfalls eine "krumme" Zahl heraus; Molekül B ist ebenfalls ein Olefin.
Molekül C, das Cyclopentadienyl-Kation, ist durch die sp²-Hybridisierung am Carbokation ebenfalls vollständig konjugiert. Cyclisch und planar trifft ebenfalls zu, fehlen nur noch die π-Elektronen. Wie auch beim Molekül A sind hier vier π-Elektronen vorhanden und somit ist n = 1/2, da es keine ganze Zahl ist ist dieses Molekül kein Aromat. Mit der [4n] π-Elektronen-Regel (für Antiaromaten) kommt man auch auf n = 1, somit ist es ein Antiaromat.
Molekül D unterscheidet sich in den ersten drei Punkten nicht, doch gemäß der Hückel-Regel hat es 6 π-Elektronen und somit n = 1, Molekül D ist somit ein Aromat!
Molekül E ist ebenfalls cyclisch, planar und konjugiert. Nach der Hückel-Regel erhalten wir keine ganze Zahl für n, jedoch nach der Hückel-Regel für Antiaromaten, denn hier ist n = 1 (4 * 1 = 4 π-Elektronen). Somit wäre Molekül E ein Antiaromat, wenn man denn mit der Hückel-Näherung ansetzen würde, darf man jedoch nicht, da die Hückel-Regel nur für monocyclische Systeme gilt!
Grenzen der Hückel-Regel:
Die Berechnung der Hückel-Näherung bzw. die Anwendung der Hückel-Regel ist relativ einfach, jedoch darf man sie nur für monocyclische Systeme verwenden!

Zitat
Das ist nicht richtig. Denn für n = 1 geht es wunderbar auf mit den 4 Elektronen. Das Cyclopentadienyl-Kation ist eine klassische anti-aromatische Verbindung.