Sie sind nicht angemeldet.
Lieber Besucher, herzlich willkommen bei: treffpunkt-naturwissenschaft.com. Falls dies Ihr erster Besuch auf dieser Seite ist, lesen Sie sich bitte die Hilfe durch. Dort wird Ihnen die Bedienung dieser Seite näher erläutert. Darüber hinaus sollten Sie sich registrieren, um alle Funktionen dieser Seite nutzen zu können. Benutzen Sie das Registrierungsformular, um sich zu registrieren oder informieren Sie sich ausführlich über den Registrierungsvorgang. Falls Sie sich bereits zu einem früheren Zeitpunkt registriert haben, können Sie sich hier anmelden.
Auf der Seite sieht man die Wellenfunktionen für die p-Orbitale zum Beispiel.
Ich verstehe in keinster Weise, warum p_z nur von einem Winkel und p_x und p_y von zwei Winkeln abhängt.
Zitat
Und ich verstehe bei der Wikitabelle auch nicht warum die Anzahl der Gesamtknoten kleiner als die Summe von radialen und
winkelabhängigen Knoten ist.
px,py,pz ist etwas anderes als m = -1 , m = 0 , m = +1

Die Form der Orbitale kann durch die Begrenzungsflächen dargestellt werden ; eine Fläche, die eine definierte Wahrscheinlichkeitsdichte aufweist ( typischerweise 90% ).
Ein-Elektronen-Wellenfunktionen nennt man Atom-Orbitale. Aus historischen Gründen ist die Nomenklatur der Atom-Orbitale für verschiedene Nebenquantenzahlen l :
l = 0 ; s-Orbital
l = 1 ; p-Orbital
l = 2 ; d-Orbital
l = 3 ; f-Orbital
Die Form der Orbitale kann durch die Begrenzungsflächen dargestellt werden ; eine Fläche, die eine definierte Wahrscheinlichkeitsdichte aufweist ( typischerweise 90% ).

Der Abbildung ist z.B. zu entnehmen, dass das s-Orbital kugelsymmetrisch ist. Seine Kugelflächenfunktion Y₀₀ ist unabhängig vom Winkel.
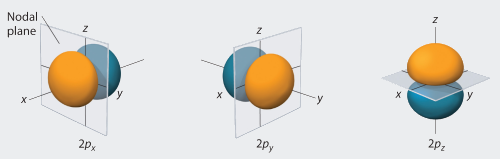
Bei den drei p-Orbitalen könnte man intuitiv vermuten, dass es sich um drei exakt gleiche Orbitale handelt ( da ja alle drei hantelförmig sind ). Dem ist aber nicht so. Die drei p-Orbitale mit einer vorgegebenen Hauptquantenzahl n korrespondieren mit den unterschiedlichen Werten der Magnetquantenzahl ml, nämlich 0, -1 und +1. Das pz-Orbital ( wobei man die z-Achse oft als Bezugsachse definiert ) ist ein "reales" Orbital und hat keine Drehimpulskomponente bezüglich der z-Achse. Die anderen beiden Orbitale, p+ und p-, sind komplex und haben ihre maximale Amplitude in der xy-Ebene. Die drei genannten Orbitale lassen sich wiedergeben durch :
\[ p_z = ( \frac{3}{4 \pi} )^{\frac 1 2} R_{n1}(r) \cdot cos (\vartheta) \]
\[ p_+ = ( \frac{3}{8 \pi} )^{\frac 1 2} R_{n1}(r) \cdot sin (\vartheta) \cdot e^{i \varphi } \]\[ p_- = - ( \frac{3}{8 \pi} )^{\frac 1 2} R_{n1}(r) \cdot sin (\vartheta) \cdot e^{- i \varphi } \]
Üblicherweise bildet man die realen und die imaginären Komponenten ab und nennt diese - aus Linearkombination entstandenen - Orbitale dann "px" und "py" :
\[ p_x = \frac{1}{\sqrt 2} \cdot (p_- - p_+) = ( \frac{3}{4 \pi} )^{\frac 1 2} \cdot R_{n1}(r) sin (\vartheta) cos (\phi) \]
\[ p_y = \frac{i}{\sqrt 2} \cdot (p_- + p_+) = ( \frac{3}{4 \pi} )^{\frac 1 2} \cdot R_{n1}(r) sin (\vartheta) sin (\phi) \]
Die Darstellung der p-Orbitale :
<img src="http://fs5.directupload.net/images/160101/ydugyuha.png" alt="wysiwyg image" style="font-size: 12.8px;" />
Kurz zusammengefasst : Der ( feine ) Unterschied zwischen den einzelnen p-Orbitalen ist, dass nur das pz-Orbital ein "echtes" Orbital ist während die anderen beiden Orbitale px und py Linearkombinationen darstellen. Damit sollte auch die Winkelabhängigkeit klar sein : das pz-Orbital ist nur abhängig vom Polarwinkel θ, während die px- und py-Orbitale zusätzlich eine Abhängigkeit vom Azimutwinkel φ aufweisen ( in Kugelkoordinaten ). Bitte das Thema "Kugelkoordinaten" nachschlagen ( falls noch nicht bekannt ), ich habe es bereits verlinkt.

Dieser Beitrag wurde bereits 1 mal editiert, zuletzt von »Harve« (7. Januar 2016, 13:25)
