Sie sind nicht angemeldet.
Lieber Besucher, herzlich willkommen bei: treffpunkt-naturwissenschaft.com. Falls dies Ihr erster Besuch auf dieser Seite ist, lesen Sie sich bitte die Hilfe durch. Dort wird Ihnen die Bedienung dieser Seite näher erläutert. Darüber hinaus sollten Sie sich registrieren, um alle Funktionen dieser Seite nutzen zu können. Benutzen Sie das Registrierungsformular, um sich zu registrieren oder informieren Sie sich ausführlich über den Registrierungsvorgang. Falls Sie sich bereits zu einem früheren Zeitpunkt registriert haben, können Sie sich hier anmelden.
Weil man die Kationen der so genannten H2S - Gruppe ursprünglich durch Einleiten von H2S in die stark saure Probelösung gefällt hat.
Warum heißt der H2S Gangso wie er heißt.
Laut Wiki https://de.wikipedia.org/wiki/H%E2%82%82S-Gang hat das ja nichts mit Schwefelwasserstoff zu tun.
Zitat
Aber der Schritt wie man von Al(H2O)6) 3+ auf Al2O3 kommt ist nicht ganz klar. Das Aluminiumoxid entsteht logischerweise nach dem Glühen. Aber der Zwischenschritt. Kann mir den jmnd. erläutern?
Warum [ Al(H2O)6], also warum 6 Wassermoleküle für ein Al-Ion. Aluminium ist doch kein Nebegruppenelement. Mir
Zitat
Aber der Schritt wie man von Al(H2O)6) 3+ auf Al2O3 kommt ist nicht ganz klar. Das Aluminiumoxid entsteht logischerweise nach dem Glühen. Aber der Zwischenschritt. Kann mir den jmnd. erläutern?
Die Fällungsform ist ein Aluminiumhydroxid mit undefinierten Wassergehalt. Eine stöchiometrisch definierte Form, also auch mit definiertem analytischem Faktor erhält man erst nach vollständigem Entfernen des gesamten Wassers mit der Wägeform Al2O3.
Falls Sie [Al(H2O)6] 3+ , also das Hexaquaaluminium(III) Ion als "Zwischenschritt" verstehen , dann passt die Frage nicht, weil der Zwischenschritt eine Reaktion und nicht nur ein Ion sein sollte.
Auf Verdacht : \[ [Al (H_2O)_6]^{3+} \ + \ 3 \ OH^- \ -> \ Al(OH)_3 \ + \ 6 \ H_2O \] \[ 2 \ Al(OH)_3 \ -> \ Al_2O_3 \ + \ 3 \ H_2O \]
Gruß FKS
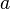 ist eine thermodynamische Größe, die in der physikalischen Chemie anstelle der Stoffkonzentration verwendet wird. Mit ihr gelten für reale Mischungen
ist eine thermodynamische Größe, die in der physikalischen Chemie anstelle der Stoffkonzentration verwendet wird. Mit ihr gelten für reale MischungenAlle Ionen liegen in wässriger Lösung hydratisiert vor. Die Zahl der dabei angelagerten H2O - Moleküle , die Hydratationszahl, ist nicht exakt definiert.Warum [ Al(H2O)6], also warum 6 Wassermoleküle für ein Al-Ion. Aluminium ist doch kein Nebegruppenelement. Mir
ist zu Ohren gekommen, dass es bei Nebengruppenelementen, die Übergangsmetalle sind, so ist.
Also mir ist zu Ohren gekommen, dass jedes Übergangsmetall Kation von 6 H2O Molekülen umlagert wird, beim Aufstellen von
Was aber nach BRÖNSTED nicht funktioniert, weil nach dessen Defintion die Aufnahme von OH- nicht als Säurereaktion zählt. Es müssen also sauer reagierende H - Atome in die Formel. Was man dadurch erreicht, dass man annimmt, dass unbeschadet weiterer gebundener Wassermoleküle jedes Kation in erster Sphäre oktaedrisch von 6 Wassermolekülen umgeben ist und man dann frohgemut das Aluminiumion als "Protonendonator" und somit als BROENSTED - Säure reagieren lassen kann.
\[ [Al(H_2O)_6]^{3+} \ + \ H_2O \ <-> \ [Al(H_2O)_5 OH]^{2+} \ + \ H_3O^+ \]
Manche halten dies für höhere Wissenschaft. Ich neige da eher dazu, eine gewisse Willkür am Werk zu sehen , zumal man ja auch nicht H(H2O)6^+ sondern H(H2O)^+ = H3O^+ schreibt und Ihr Professor ja nicht einmal die Notwendigkeit einer Erklärung erkennt.
Gruß FKS
Wie ich bereits geschrieben habe , geht es nach meiner Wahrnehmung hier weniger darum, was der chemischen Realität am nächsten kommt , sondern notfalls auch ohne Rücksicht auf Selbige eine Form zu finden, um aus hydratisierten Kationen eine BRÖNSTED - Säure zu machen. So spricht z.B. im Fall des Cu2+ mMn alles für [Cu(H2O)4]2+, dennoch wurde ich einmal damit korrigiert und habe auch in diesem noch nie etwas anderes als eine Koordinationszahl sechs gelesen.Also mir ist zu Ohren gekommen, dass jedes Übergangsmetall Kation von 6 H2O Molekülen umlagert wird, beim Aufstellen von
Reaktionsgleichungen. Aluminium ist laut Wiki kein Übergangsmetall. Wie ist das bei Bor oder Thallium?
Und wie ist das bei Elementen der 1. oder 2. Hauptgruppe.
